低分子医薬品、抗体医薬品に続く次世代の医薬品と言われているのが「核酸医薬品」です。「核酸医薬品」は、これまで治療が難しかった疾患を治療する可能性を秘めた医薬品として期待と注目を集めています。
その「核酸医薬品」の製造に、じつは味の素グループの技術が導入されています。
今回の記事では、なぜ医薬品の製造に味の素グループが携わっているのか、どのような技術が活用されているのか、紐解いていきます。
新薬の開発・製造にイノベーションを起こす「AJIPHASE®」
病気を治療し、健康な生活を送るために、薬はなくてはならないものです。しかし、新薬が患者さんの元に届くまでには、研究開発から臨床試験、規制当局の承認と、様々な道のりをたどる必要があります。
特に薬の製造に着目すると、従来から作られている医薬品は製薬会社で製造されていますが、次世代医薬品である「核酸医薬品」の場合は、専用の設備や技術的なノウハウが多く必要とされるため、製薬会社が第三者であるCDMO※に製造を委託するのが一般的です。
※CDMO(Contract Development and Manufacturing Organization):医薬品の開発業務や製造業務を受託する企業のこと
ただ、臨床試験までの小規模製造と、臨床試験以降用の大規模製造とでは製造規模が大きく異なるため、そのまま委託はできず、製造プロセスのスケールアップが必要です。
しかし「核酸医薬品」を製造する際の一般的な方法である「固相合成法」では、このスケールアップを行う際、しばしば品質やコスト面での課題が生じます。
味の素グループは、この課題を画期的な新製法「AJIPHASE®」で解決しました。
「AJIPHASE®」は、味の素グループが独自に開発した技術で、一般的な合成手法である「固相合成法」と「液相合成法」を組み合わせたハイブリッド型の合成技術
です。この技術により、高品質な原薬を効率的に大量製造することを可能にしたのです。
アミノサイエンス®を医薬品製造に応用する味の素グループ
では、なぜ味の素グループがこの「AJIPHASE®」の技術を開発できたのでしょうか。
味の素グループは、創業以来100年以上にわたって、アミノ酸に関する機能や技術の研究を続け、さまざまな事業を展開してきました。
1980年代後半からは、製薬会社が開発した医薬品原薬の受託製造事業を開始。1990年代には、エイズ・単純ヘルペス・高血圧の治療に使用される医薬品の供給に貢献しました。
そして、2005年(平成17年)からは、複数のアミノ酸で構成されており、また多くの医薬品として実用化されている「ペプチド」の合成へ展開を進めてきました。これが、現在の「AJIPHASE®」の技術へとつながっています。
大量製造を可能にした「アンカー」によるブレークスルー
「核酸医薬品」に使われるオリゴ核酸やペプチドを合成する一般的な方法は、専用の合成機を使用する「固相合成法」と呼ばれる手法です。
この製造方法は完全に自動化されており、スピーディーではあるものの、1回で合成できる量は専用の合成機のサイズに依存しているため限定的です。また、多くの医薬品原薬製造で一般的に用いられている「液相合成法」に比べて反応効率が悪く、各ステップで残った試薬を除去するために有機溶媒を使った洗浄を、次の反応工程に進む前に行う必要があることから、有機溶媒や原料の消費量が多くなってしまっていました。

従来の「固相合成法」で使用する専用の合成機
一方で「AJIPHASE®」では、「固相合成法」で使われていた樹脂担体(核酸を固定化するための素材)を「アンカー」と呼ばれる有機溶媒に溶ける化合物に置き換えることで、試薬を分子レベルで均一に分布させ、良好な反応効率を実現しました。
また、「固相合成法」とは異なり汎用的な合成設備を用いることができ、タンクのサイズを大きくすることで、簡単にスケールアップを行うことも可能です。

汎用的な設備を使い工業規模での製造もおこなえる「AJIPHASE®」
また、この「アンカー」は特定の有機溶媒には溶解するものの、別の特定の有機溶媒には溶解しないという特徴を持っています。この特徴を活かすことで、簡単な洗浄でも反応に使用したすべての試薬を除去することができ、使用する有機溶媒や原料の量を低減させ、環境負荷を減らすことを可能にしました。
医薬品の開発では、開発ステージによって、必要な製造量は異なります。
「AJIPHASE®」の開発により、味の素グループでは、製薬会社のニーズに合わせて、「固相合成法」と「AJIPHASE®」を使い分け、フレキシブルな提案を実現しています。
核酸をベースとした医薬品製造への挑戦
「核酸医薬品」で治療ができる代表的な疾患として、先天性筋ジストロフィーがあげられます。
先天性筋ジストロフィーの患者さんは、遺伝子変異によって筋肉が機能するのに必要なジストロフィンというたんぱく質の生成ができなくなります。その結果、筋力低下が起こり、歩くことが困難になり、運動能力の喪失、極端な場合には呼吸、嚥下、さらには血液循環の問題につながります。
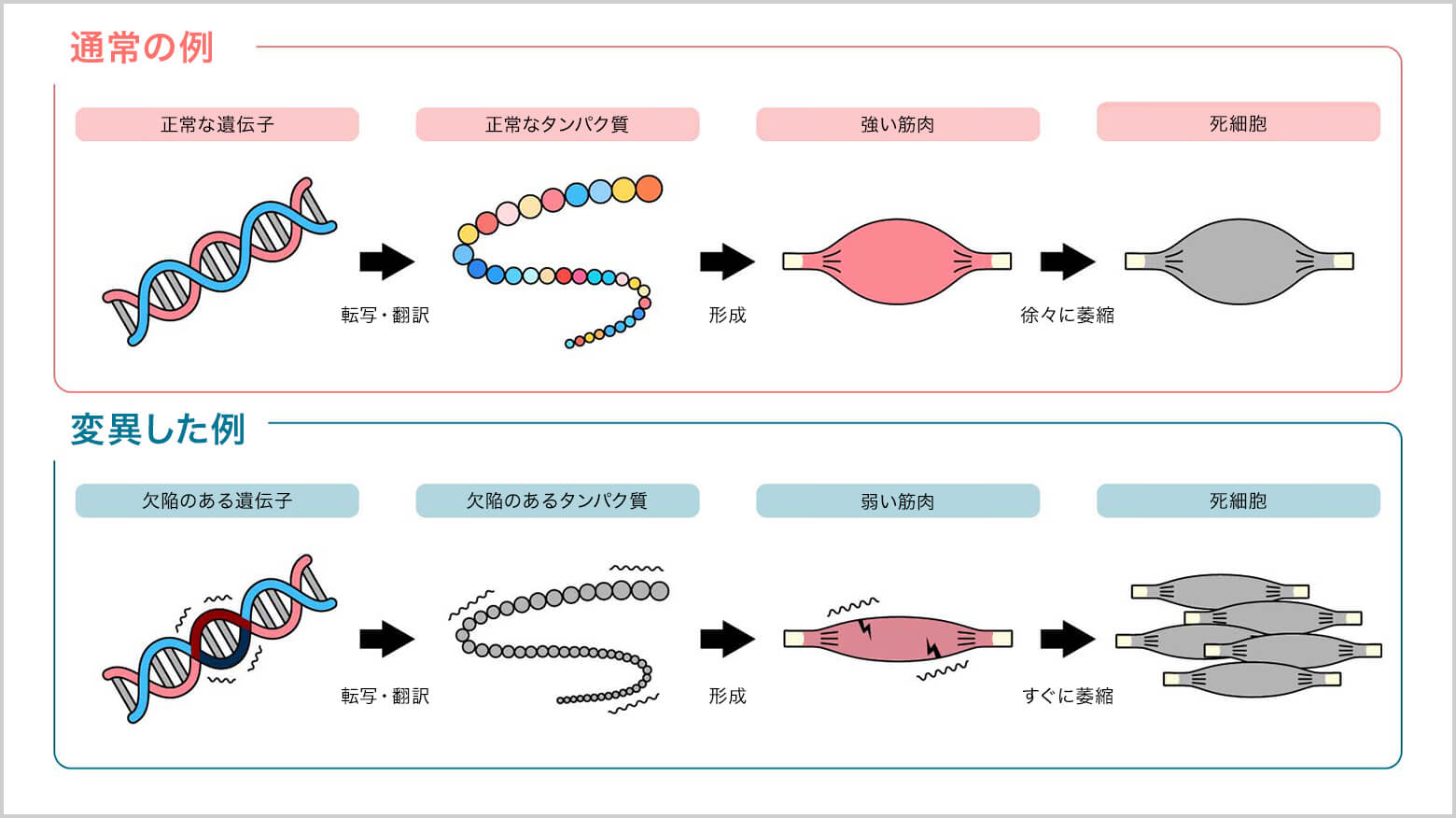
これまでの治療法には筋肉細胞の死を抑制するため、副腎ステロイドが含まれる低分子薬と、筋肉の発達を抑制するたんぱく質ミオスタチンの作用を阻害する、抗ミオスタチン治療薬がありました。
しかし、いずれの治療法も必ずしもすべての方の治療を可能にすることは証明されていませんでした。
一方、「核酸医薬品」では、遺伝情報を制御し、標的となるたんぱく質の機能を阻害する能力があるため、たんぱく質複製中に変異した遺伝子をスキップすることが可能です。
過去10 年間に先天性筋ジストロフィー治療のための「核酸医薬品」は、米国食品医薬品局(FDA)にいくつか承認されており、さらに神経疾患やその他の症状の治療にも顕著な効果をもたらす可能性を秘めています。そのため対象となる組織や臓器の範囲を拡大するための研究は加速し、核酸医薬品事業の今後の成長に大きな期待が寄せられているのです。
味の素グループでは、2011年(平成23年)よりオリゴ核酸のひとつである「モルホリノ核酸」の製造へ「AJIPHASE®」の技術を応用し始め、2015年(平成27年)には、「AJIPHASE®」の次の創薬モダリティとして、核酸医薬の技術開発の新たなフェーズを開始しました。
そして2020年(令和2年)、「AJIPHASE®」の技術を使用して製造された最初の医薬品が、米国食品医薬品局(FDA)に承認されています。
「核酸医薬品」をはじめとする最先端の治療法を製薬会社にお届けするために、私たち味の素グループは、「アミノサイエンス®」を最大限に活用し、「AJIPHASE®」技術の進歩、そして製薬会社とその先にいる患者さんにとって最良の技術を提供できるよう、たゆまぬ研究を続け、世界中の人々の健康に貢献していきます。
ぺプチドオリゴ核酸合成_AJIPHASE_2018JP
2024年6月の情報をもとに掲載しています。

関連情報